「iPS細胞由来ドパミン神経前駆細胞を用いたパーキンソン病治療に関する医師主導治験」開始について
平成30年7月30日
1.概要
京都大学医学部附属病院は、京都大学iPS細胞研究所と連携し、「iPS細胞由来ドパミン神経前駆細胞注1を用いたパーキンソン病治療に関する医師主導治験」を計画してきました。平成30年6月4日付で独立行政法人医薬品医療機器総合機構(PMDA)に医師主導治験として治験計画届を提出し、この度、平成30年8月1日より治験を開始する運びとなりました。そこで、治験開始について下記のとおり発表いたします。
2.経過
平成30年4月 6日
京都大学医学部附属病院治験審査委員会へ申請
平成30年4月24日
京都大学医学部附属病院治験審査委員会より条件付き承認
平成30年6月 4日
PMDA(独立行政法人医薬品医療機器総合機構)を通じ、
厚生労働大臣へ治験計画届書を提出
3.治験計画の概要
- (1) 治験課題名
下記2つの医師主導治験を計画して実施いたしますが、同一の患者さんにご参加いただきます。
課題名1:パーキンソン病に対するヒトiPS細胞由来ドパミン神経前駆細胞の細胞移植による安全性及び有効性を検討する医師主導治験(第Ⅰ/Ⅱ相)
課題名2:パーキンソン病に対するヒトiPS細胞由来ドパミン神経前駆細胞の細胞移植時におけるタクロリムス注2の安全性及び有効性を検討する医師主導治験(第Ⅲ相)
- (2) 治験の目的
課題名1:パーキンソン病患者を対象に、ヒトiPS細胞由来ドパミン神経前駆細胞を線条体注3に移植することによる安全性及び有効性の評価を行います。
課題名2:パーキンソン病患者を対象に、ヒトiPS細胞由来ドパミン神経前駆細胞を線条体に移植した被験者に対するタクロリムスの安全性及び有効性の評価を行います。
- (3) 治験の内容
京都大学iPS細胞研究所で構築している「再生医療用iPS細胞ストック注4」から提供されたiPS細胞をドパミン神経前駆細胞へ分化させ、ドパミン神経前駆細胞を被験者の脳に移植します(他家移植)。また、細胞移植後に免疫反応が起こる可能性があるため、本治験では、既に臓器移植等において臨床実績のあるタクロリムスを細胞移植時の免疫抑制剤として使用します。
- (4)対象疾患
パーキンソン病
- (5)主な適格基準
【選択基準】
1)パーキンソン病である
2)既存の薬物治療では症状のコントロールが十分に得られていない
3)同意取得時の年齢が50才以上70才未満である
4)罹病期間が5年以上である
5)オフ時のHoehn&Yahr重症度分類がstageⅢ以上である
6)オン時のHoehn&Yahr重症度分類がstageⅢ以下である
7)L-ドパ反応性が30%以上である
等
【除外基準】
1)頭部MRI において症候性の器質的病変が認められる
2)免疫機能異常がある
3)認知症または認知症のリスクが高いと判断される
4)出血傾向または凝固機能異常がある
等
-
(6)細胞移植について
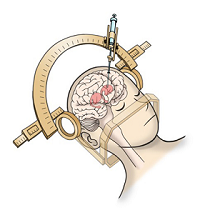
iPS細胞から分化誘導したドパミン神経前駆細胞(計約500万個)を、定位脳手術注5により、患者さんの脳の線条体部分(左右両側)に移植します。
図 ドパミン神経前駆細胞を移植する手術の様子
手術は、頭部を固定した上で頭蓋骨に直径12mmの穴を開け、そこから注射針のような器具を用い、細胞を注入する。
- (7) 実施予定人数
7人
- (8) 観察期間注6
移植後2年間(一人の患者さんあたり)
- (9) 治験参加患者の募集
詳細はこちらをご参照ください。
http://neurology.kuhp.kyoto-u.ac.jp/ips-pd/ips-pd.html
4.治験実施体制
- 〇主任研究者:
京都大学iPS細胞研究所
髙橋 淳 臨床応用研究部門 教授
- 〇自ら治験を実施する者:
京都大学医学部附属病院
髙橋 良輔 脳神経内科 教授
実施診療科
脳神経内科、脳神経外科、放射線診断科
被験者選定、移植実施、術前術後の評価、重篤な有害事象報告および不具合報告、
安全性情報の取り扱い、症例報告書作成および報告、モニタリング、データマネジメント、
統計解析、画像評価
- 〇治験製品等の提供機関:
1)京都大学iPS細胞研究所
iPS細胞の樹立・評価、移植細胞の製造・評価、提供
2)東和薬品株式会社
治験薬(免疫抑制剤タクロリムス)の提供
3)株式会社 トップ
細胞投与機器の製造、提供
- 〇治験への協力機関:
1)日本メジフィジックス株式会社
PET薬剤の製造
5.本治験の支援
本治験は、下記機関より支援を受けて実施されます。
- ・国立研究開発法人 日本医療研究開発機構(AMED)
再生医療実現拠点ネットワークプログラム疾患・組織別実用化研究拠点(拠点A)
「パーキンソン病、脳血管障害に対するiPS細胞由来神経細胞移植による機能再生治療法の開発」
再生医療実用化研究事業
「パーキンソン病に対するヒトiPS細胞由来ドパミン神経前駆細胞の細胞移植による安全性及 び有効性を検討する臨床試験(治験)に関する研究」
再生医療の産業化に向けた評価手法等の開発
「パーキンソン病に対する機能再生療法に用いるiPS細胞由来神経細胞製剤の開発」
- ・大日本住友製薬株式会社
6.用語説明
- 注1)ドパミン神経前駆細胞
ドパミンは神経伝達物質の一つで、ドパミン神経細胞の中で作られます。パーキンソン病は、ドパミン神経細胞が進行性に失われ、ドパミン産生量が減少することにより発症します。ドパミン神経前駆細胞は、ドパミン神経細胞に分化する手前の細胞です。パーキンソン病モデル動物を用いた研究から、ドパミン神経前駆細胞を移植することによって脳内に成熟ドパミン神経細胞を効率的に生着させられることが明らかになっています。
- 注2)タクロリムス
臓器移植後などに拒絶反応を抑制するために汎用されている免疫抑制剤の一つ。
- 注3)線条体
大脳基底核の主要な構成要素の一つ。
- 注4)再生医療用iPS細胞ストックプロジェクト
多くの方に免疫拒絶を起こしにくい、特別な細胞の型(HLAホモ接合体)をもつ健康なドナーからiPS細胞を作製し、予め様々な品質評価を行った上で、再生医療に使用可能なiPS細胞株を保存するプロジェクト。
- 注5)定位脳手術
頭蓋に小さな穴を開け、脳深部の目的の場所に針を穿刺したり、電気刺激装置を埋め込んだりする手術。現在パーキンソン病患者さんに行われている脳深部刺激療法(DBS手術)も定位脳手術です。
- 注6)観察期間
本治験では、一人の患者さんについて移植後2年間の観察期間を設けます。最後に参加いただいた患者さんの観察期間終了後、治験で得られたデータを評価して結果をまとめるなどの手続きが必要です。治験の結果がすぐに出るわけではありません。治験結果は、公開可能となった段階で情報公開します。