2025年4月17日
(概略)
京都大学医学部附属病院は、京都大学iPS細胞研究所と連携し、「iPS細胞由来ドパミン神経前駆細胞(注1)を用いたパーキンソン病治療に関する医師主導治験」を実施しました。2018年6月4日付で独立行政法人医薬品医療機器総合機構(PMDA)に医師主導治験として治験計画届を提出し、2018年8月1日より治験を開始しました。その研究成果がNature誌2025年4月17日号に掲載されることとなりました。
7名のパーキンソン病患者を対象に、iPS細胞由来のドパミン神経前駆細胞を脳内の被殻(注2)に両側移植しました。主要評価項目は安全性および有害事象の発生で、副次評価項目として運動症状の変化およびドパミン産生を24カ月間にわたり観察しました。その結果、重篤な有害事象は発生しませんでした。iPS細胞由来のドパミン神経前駆細胞は生着し、ドパミンを産生し、腫瘍形成を引き起こさなかったことが示されました。これにより、パーキンソン病に対する安全性と臨床的有益性が示唆されました。
1.背景
パーキンソン病では、中脳黒質(注2)のドパミン神経細胞が減少し、それによって動作緩慢、筋強剛、静止時振戦を特徴とする運動症候群を発症します。薬物療法は、初期の段階では運動症状を効果的に緩和しますが、長期に経過すると運動合併症や薬剤誘発性ジスキネジア(不随意運動)など対応が難しい問題が生じます。そのため、失われたドパミン神経細胞を補充する細胞治療が代替治療法として検討されてきました。欧米では、ヒト中絶胎児の脳を移植する治験が行われてきましたが、倫理的問題や安定した供給の困難さが指摘されてきました。iPS細胞研究所の髙橋淳教授らの研究グループはこれまでに、ヒトiPS細胞からドパミン神経細胞を誘導する方法を開発し、サルのパーキンソン病モデルの脳内でドパミンを産生し、運動症状を改善することを確認してきました。
2.研究手法・成果
50~69歳の7名のパーキンソン病患者を対象に、iPS細胞由来のドパミン神経前駆細胞を脳内の被殻に両側移植しました。
主要評価項目は安全性および有害事象の発生で、副次評価項目として運動症状の変化およびドパミン産生を24カ月間にわたり観察しました。
その結果、重篤な有害事象は発生しませんでした。MRI(注3)による評価では、移植組織の異常増殖は認められませんでした。
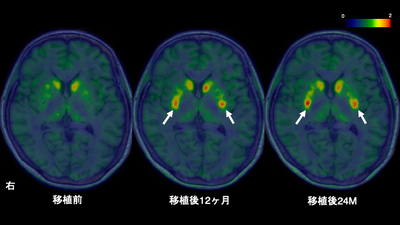
また、有効性評価の対象となった6名の患者のうち、4名が「国際パーキンソン病・運動障害学会統一パーキンソン病評価尺度(MDS-UPDRS)パートIII(注4)」のOFFスコア(注5)において改善を示しました。さらに、18F-DOPA PET(注6)では、被殻のドパミン神経の活動が増加していました(下図:移植後に新たに観察されたドパミン神経の活動を矢印で示す)。以上から、iPS細胞由来のドパミン神経前駆細胞が生着し、ドパミンを産生し、腫瘍形成を引き起こさなかったことが示されました。これにより、パーキンソン病に対する安全性と臨床的有益性が示唆されました。
 |
3.波及効果、今後の予定
この治療を一日も早く世界中の患者さんにお届けするために、実用化に向けて取り組んでいます。日本国内では、国による承認申請に向けて製薬会社が準備を進めています。海外での実用化も目指し、米国カリフォルニア大学サンディエゴ校では2023年11月から医師主導治験が開始されています。
本研究は高橋淳教授に対する日本医療研究開発機構(AMED)の再生医療等実用化研究事業「パーキンソン病に対するヒトiPS細胞由来ドパミン神経前駆細胞の細胞移植による安全性及び有効性を検討する臨床試験(治験)に関する研究(23bk0104126h0003)」の支援の下で実施されました。また、本件に関する基盤研究は、AMED の再生医療実現拠点ネットワークプログラム(疾患・組織別実用化研究拠点(拠点 A))「パーキンソン病、脳血管障害に対する iPS 細胞由来神経細胞移植による機能再生治療法の開発(22bm0204004h0010)」の支援で実施されました
<論文タイトルと著者>
タイトル:Phase I/II trial of iPS-cell-derived dopaminergic cells for Parkinson’s disease