2025年5月7日
三洋化成工業株式会社
京都大学医学部附属病院
三洋化成工業株式会社(本社:京都市東山区、代表取締役社長:樋口 章憲、以下、三洋化成)は、この度、京都大学医学部附属病院形成外科 森本尚樹 教授ら(以下、京大病院)との共同研究により開発いたしました新規の創傷治療材料シルクエラスチン®創傷用シート」 (以下、「本製品」)の薬事承認を取得いたしましたので、お知らせいたします。本製品については、科研製薬株式会社(本社:東京都文京区、代表取締役社長:堀内 裕之、以下「科研製薬」)に日本国内における独占販売権を付与しており、同社が販売を担当します。なお、本製品は、日本初の遺伝子組み換え技術を用いた医療機器となります。
【概要】
やけどやケガ、皮膚がんの切除などで皮膚が欠損した場合、通常の治療では治りにくい「慢性創傷」(難治性皮膚潰瘍)と呼ばれる傷が発生することがあります。慢性創傷は、糖尿病、静脈還流障害、床ずれ、膠原病などさまざまな原因で引き起こされます。創傷の治療には、創面を湿潤に保ちながら、細菌感染を防ぐことが重要です。しかし、慢性創傷は治癒に時間がかかるため細菌感染のリスクが高くなり、感染すると治癒がさらに遅れるという悪循環に陥りがちです。
本製品は、このような治りにくい慢性創傷の治癒を目的に、三洋化成が京大病院とともに開発を進めてきた新しい治癒材です。これまでの臨床試験のデータから従来の治療で効果が得られにくいような慢性創傷でも、細菌感染を助長させることなく治療できる製品となっており、治療期間の短縮や痛みの軽減を通して患者さんのQOLの向上に貢献することが期待されます。
シルクエラスチン®創傷用シート |
シルクエラスチン®創傷用シートの適用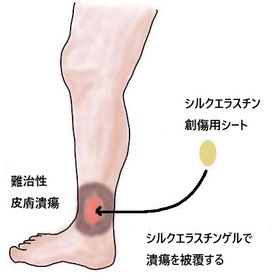 |
1.新製品
販売名 :シルクエラスチン®創傷用シート
承認番号:30700BZX00089000
一般名称:吸収性創傷被覆・保護材
使用目的又は効果 :全層創傷及び部分層創傷の治癒を目的に使用する。特に、既存治療に奏効しない難治性創傷にも適応となる。
2.販売開始予定
本製品の販売については、科研製薬より、2025年秋以降に日本国内で販売開始する予定です。
※販売開始時期は、保険償還手続きの状況等により変更となる可能性があります。
【補足説明】
<慢性創傷治癒材としてのシルクエラスチン®創傷用シートについて>
シルクエラスチン®は、シルクフィブロイン(1)の部分配列とエラスチン(2)の部分配列とを組み合わせ、遺伝子組み換え技術によって作製された人工タンパク質です(図1)。シルクエラスチン水溶液は加温するとタンパク質の構造が変化し、水分を含んだ状態で固まる(ゲル化する)という特徴があり、複雑な創傷面に密着して細胞増殖の環境を作り出します。
(1) シルクフィブロイン:カイコが産生する繊維状のタンパク質であり、シルクの原料になる。
(2) エラスチン:弾性線維を構成する主要なタンパク質。皮膚や肺、動脈が伸縮するのは弾性線維の働きによる。
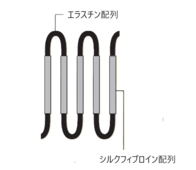
図1.シルクエラスチン®の構造 |
|
<臨床試験について>
京大病院で2018年2月から12月まで、下腿難治性皮膚潰瘍を対象として、シルクエラスチン®創傷用シートを用いた医師主導治験を行い、本材料の安全性を確認しました。また、2021年7月より実施していた企業治験において、安全性と有効性の両面で良好な結果が得られました。
※いずれの治験も国立研究開発法人日本医療研究開発機構(AMED) 医工連携イノベーション推進事業の支援を受けて実施いたしました。
【お問い合わせ先】
三洋化成工業株式会社 コーポレート・ガバナンス部
〒605-0995 京都市東山区一橋野本町11-1
TEL:075-541-4312
E-mail:pr-group@sanyo-chemical.group
注意事項:
このニュースリリースに記載されている事業に関する将来の見通し等の記述は、現時点で入手可能な情報から予測したものであり、今後の様々な要因により実際の結果とは異なる可能性があります。また、このニュースリリースに含まれている医薬品(開発中のものを含む)に関する記述は、宣伝、広告等や医学的アドバイスを目的としたものではありません。